
Como a Covid-19 está impactando atividades de pesquisa clínica no Brasil
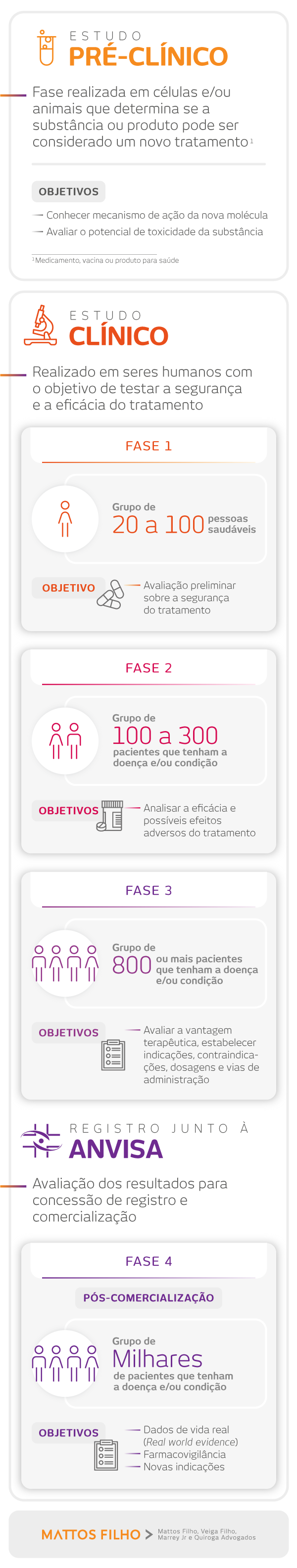
Veja as principais etapas envolvendo a pesquisa e desenvolvimento de novos tratamentos
Mesmo antes do início da pandemia, a indústria farmacêutica já vinha empenhando um grande esforço na pesquisa e desenvolvimento de drogas e vacinas contra a Covid-19. Para tanto, faz-se necessária a realização de ensaio clínicos, que são estudos baseados em diretrizes científicas que objetivam: a descoberta ou confirmação de efeitos, indicações terapêuticas e/ou a identificação de reações adversas ao produto investigado, de forma a determinar sua eficácia e segurança em voluntários humanos.
Para entender quais são as principais etapas entre o desenvolvimento de um tratamento e sua aplicação em pacientes de forma segura e eficaz, preparamos o infográfico abaixo:
Estudos clínicos em seres humanos demandam a avaliação de aspectos éticos, que devem observar essencialmente fatores como: respeito à dignidade humana e autonomia do sujeito de pesquisa; riscos e benefícios da pesquisa (individuais e/ou coletivos); evitar danos previsíveis; e relevância social.
No Brasil, esta análise é de responsabilidade da Comissão Nacional de Ética em Pesquisa (Conep), entidade ligada ao Conselho Nacional de Saúde (CNS), bem como de Comitês de Ética em Pesquisa (CEPs) estabelecidos em hospitais, centros de pesquisa e instituições acadêmicas. Além disso, a Agência Nacional de Vigilância Sanitária (Anvisa) também pode regular o tema em alguma medida, especialmente caso o ensaio clínico tenha como objetivo o registro de um produto no Brasil para sua posterior comercialização, aprovados pela Agência antes do início dos estudos.
Marco Legislativo
Atualmente, a Câmara dos Deputados discute o
Projeto de Lei nº 7.082/2017 que dispõe sobre a pesquisa clínica com seres humanos e institui o Sistema Nacional de Ética em Pesquisa Clínica com Seres Humanos. O Projeto de Lei já foi aprovado pelo Senado Federal e discutido nas Comissões de Comissão de Ciência e Tecnologia, Comunicação e Informática (CCTCI) e Segurança Social e Família (CSSF) da Câmara. No momento, aguarda parecer da Comissão de Constituição e Justiça e Cidadania (CCJC).
Trata-se de uma importante medida para harmonizar princípios éticos e diretrizes que norteiam o desenvolvimento da pesquisa clínica no Brasil, atualmente regulado apenas através de resoluções do Conselho Nacional de Saúde. O texto propõe uma série de mudanças visando o progresso e a fluidez dos processos inerentes aos estudos clínicos, como o fim de duplas aprovações éticas, além de critérios para obrigatoriedade de fornecimento de tratamento aos participantes após o término do estudo clínico.
Pesquisa Clínica no âmbito da Covid-19
De acordo com dados da Conep, já foram emitidos pareceres de aprovação ética para cerca de 384 protocolos de pesquisas científicas relacionadas ao coronavírus. Os estudos têm características metodológicas diversas, além de grande variabilidade no número de participantes de pesquisa, desde uma pessoa (relato de caso), passando por 1.300 (ensaio clínico) até a previsão de inclusão de mais de 14.000 pessoas (estudo epidemiológico de base populacional).
Confira abaixo um compilado das principais informações divulgadas até o momento pela Conep a respeito destes estudos:

Fonte: Boletim Ética em Pesquisa da Comissão Nacional de Ética em Pesquisa, Relatório Semanal 21 (Ed. 01/06/2020).
Sobre Hidroxicloroquina
No que se refere a diretrizes técnicas para
prescrição de Difosfato de Cloroquina e Hidroxicloroquina, o Ministério da Saúde emitiu a Nota Informativa nº 5/2020, sobre critérios técnicos para prescrição de cloroquina na rede pública, no âmbito do tratamento de pacientes hospitalizados com formas graves de Covid-19.
O medicamento será distribuído pelo Ministério da Saúde às Secretarias Estaduais de Saúde, que realizarão o envio aos hospitais de referência de suas respectivas regiões.
A Nota Informativa ressalta que existem estudos clínicos nacionais e internacionais em andamento, avaliando a eficácia e segurança de cloroquina/hidroxicloroquina para o combate à Covid-19, bem como outros medicamentos. Portanto, essa medida poderá ser modificada a qualquer momento, a depender de novas evidências científicas.
Outros tratamentos para pacientes com Covid-19
A Anvisa emitiu a Nota Técnica nº 3/2020, com orientações aos patrocinadores, centros e investigadores envolvidos na condução de pesquisas clínicas relacionadas ao novo coronavírus. De acordo com o documento, a situação epidemiológica do país poderá demandar a adequação nos protocolos clínicos em andamento. Veja as principais orientações:
- Os patrocinadores, em conjunto com os investigadores clínicos e Comitês de Ética, poderão decidir pela descontinuação ou não de um participante na pesquisa clínica, objetivando preservar sua proteção. Tais decisões devem ser respaldadas por informações e justificativas sobre a necessidade de modificações ou emendas;
- Os procedimentos de triagem para Covid-19 em participantes de pesquisa clínica não precisam ser relatados à Agência como emenda ao protocolo;
- A adoção de processos alternativos ou a modificação de processos existentes deve levar em conta o protocolo clínico aprovado e a situação do local ou região onde a pesquisa clínica está sendo conduzida quanto às ações de contingência vigentes. As emendas ao protocolo clínico realizadas, exclusivamente, em virtude das medidas de enfrentamento da Covid-19 não necessitam de autorização da Anvisa, mas devem ser submetidas no relatório anual da pesquisa clínica;
- Todos os esforços para minimizar os impactos na integridade da pesquisa clínica, bem como os desvios inevitáveis do protocolo clínico em face das ações de enfrentamento da Covid-19 devem ser documentados;
Para os estudos de bioequivalência ainda não iniciados ou já iniciados, mas que ainda não tenham sido realizados um ou mais períodos de internação, sugere-se o adiamento desses períodos.
Uso de plasma como alternativa de tratamento
Considerando as recentes discussões sobre o uso do plasma convalescente para tratamento de pacientes diagnosticados com Covid-19, a Anvisa emitiu uma a Nota Técnica nº 19/2020, estabelecendo que, se a utilização pretendida envolver o uso do plasma convalescente como hemocomponente, ou seja, o plasma emitido a partir de um doador, não cabe a submissão de estudo clínico para apreciação e aprovação prévia da Agência.
Nesse caso, o procedimento deverá ter sua eficácia aprovada pelo Conselho Federal de Medicina (CFM), pelo Ministério da Saúde ou deverá ser utilizado em caráter experimental, mediante adesão às normas previstas para a realização de pesquisa em seres humanos no Brasil.
Em situações especiais, considerando a emergência de saúde pública, a gravidade da doença e a condição de risco iminente à vida do paciente, a decisão por utilizar o plasma convalescente no tratamento da Covid-19 poderá ser feita sob responsabilidade do profissional médico, com esclarecimento aos pacientes do caráter experimental e dos riscos envolvidos, mediante consentimento dos pacientes ou de seus familiares.
Outra Nota Técnica, emitida pelo Ministério da Saúde (Nota Técnica nº 21/2020), estabelece diretrizes técnicas adicionais a respeito do tema.
Regime extraordinário de submissão
Recentemente, a Anvisa publicou a
Resolução da Diretoria Colegiada nº 375, de 17 de abril de 2020, que alterou, de forma extraordinária e temporária, o regime de submissão de ensaios clínicos para validação de dispositivos médicos de classes III e IV identificados como prioritários para uso em serviços de saúde, destinados ao enfrentamento da Covid-19.
Em virtude da emergência de saúde pública, os ensaios das classes mencionadas acima poderão ser submetidos em forma de Notificação em pesquisa clínica seguindo o rito processual previsto na
Resolução da Diretoria Colegiada nº 10, de 20 de fevereiro de 2015.
Segundo a RDC nº 10/2015, somente poderiam ser sujeitos ao regime de Notificação os dispositivos médicos de classe I e II, sendo as demais classes submetidas a rito processual mais rigoroso, por serem classificados com um risco maior para o usuário.
*Colaborou Marina Battistella
Para mais informações, conheça a prática de Life Sciences e Saúde do Mattos Filho.




