

Anvisa aprova nova resolução sobre exames de análises clínicas: entenda o que muda
Confira os principais pontos da norma que substituirá a RDC Anvisa nº 302/2005 e impacta serviços farmacêuticos
Assuntos
A Agência Nacional de Vigilância Sanitária (Anvisa) publicou, em 10 de maio de 2023, o novo regulamento (RDC Anvisa n° 786/2023) que dispõe sobre os requisitos técnico-sanitários para o funcionamento de Laboratórios Clínicos, de Laboratórios de Anatomia Patológica e de outros Serviços que executam as atividades relacionadas aos Exames de Análises Clínicas (EAC) e dá outras providências. Nesse caso, estão contemplados, porém não limitado a eles, exames biológicos, microbiológicos, imunológicos, químicos, bioquímicos, imuno-hematológicos, hematológicos, citológicos, anatomopatológicos, genéticos, de biologia molecular, biologia celular, micologia, parasitologia, toxicologia, urinálise ou outros exames em material biológico de origem humana.
A norma, que entrará em vigor a partir de 01 de agosto de 2023, revoga e substitui integralmente a RDC Anvisa nº 302/2005, além de ampliar de forma significativa o rol de exames permitido em farmácias e drogarias. O tema foi objeto de ampla discussão ao longo dos últimos quatro anos, tendo contado três consultas dirigidas, dois diálogos setoriais, uma consulta pública (CP nº 912/2020), e duas audiência públicas.
A nova RDC moderniza conceitos e requisitos considerados defasados, bem como atualiza os critérios que envolvem a infraestrutura física, recursos materiais, organização, contratualização, gestão e educação de pessoal, programas de gestão de qualidade, gerenciamento de processos, tecnologias, riscos e resíduos e gerenciamento dos processos operacionais que envolvem as fases pré-analítica, analítica e pós-analítica.
Confira abaixo os principais pontos:
Novas definições
O texto aprovado conta com novos termos relevantes para interpretação normativa do tema de análises clínicas, com destaque para:
- Serviço Tipo I: abrange farmácias e consultórios isolados, definidos como estabelecimentos que realizam atividades especializadas de assistência sob responsabilidade técnica de profissional de saúde legalmente habilitado. Esta modalidade de serviço não permite a realização de: punção venosa e punção arterial; recebimento ou encaminhamento de material biológico para a realização de EAC; EAC que requeira instrumento para leitura, interpretação e visualização dos resultados, entre outros.Estes estabelecimentos são proibidos de realizarem: EAC que requeira instrumento para leitura, interpretação e visualização dos resultados; recebimento ou encaminhamento de material biológico para a realização de EAC; EAC que requeira leitura, interpretação e visualização dos resultados; guarda, armazenamento ou transporte de material biológico; atividades relacionadas à fase pré-analítica, à exceção da coleta de material biológico; punção venosa e punção arterial; EAC por meio de metodologias próprias (in house); e EAC que utiliza urina como material biológico. No entanto, os Serviços Tipo I poderão realizar EAC que requeira instrumento para leitura, interpretação e visualização dos resultados desde que sob contrato de supervisão com Serviços Tipo III, cumprindo dos seguintes requisitos: utilizar instrumento que apresente os resultados, descritos como reagente, não reagente, inválido ou apresentar um valor direto; não requeira o preparo de reagente ou o uso de água reagente produzida no serviço; não requeira leitura, interpretação e visualização remota dos resultados; em que a verificação da calibração se dê no próprio instrumento, de acordo com o manual do fabricante; não requeira leitura, interpretação e visualização remota dos resultados; realizar todas as etapas de todas as fases dos processos operacionais relacionados ao EAC no próprio Serviço (in loco); e utilizar produto para diagnóstico in vitro que requeira material biológico primário.
- Serviço Tipo II: compreende o posto de coleta definido como o serviço vinculado, do ponto de vista societário ou contratual, a apenas um laboratório clínico, que realiza a coleta e armazenamento de amostras biológicas. Esta modalidade permite a realização dos mesmos exames autorizados para Serviços Tipo I, bem como exames presenciais cuja realização ocorra no ato da coleta. Estes estabelecimentos são proibidos de realizarem a fase analítica do EAC por meio de metodologias próprias.
- Serviço Tipo III: contempla laboratórios clínicos, definido como o local que executa as atividades relacionadas aos exames de análises clínicas, compreendendo as fases pré-analítica, analítica e pós-analítica, bem como os laboratórios de anatomia patológica, que passa a ser definido como o estabelecimento que realiza atividades relacionadas aos procedimentos diagnósticos anatomopatológicos, por biópsia e citopatológicos, incluindo ato da punção aspirativa por agulha fina, imuno-histoquimica, imunofluorescência e patologia molecular, compreendendo as fases pré-analítica, analítica e pós analítica. Estes estabelecimentos poderão executar todos os EAC, bem como enviar material biológico para realização de EAC por um laboratório de apoio, ou seja, que realiza análises em material biológico enviado por Serviço Tipo III.
- Serviço de EAC itinerante: unidade que executa atividades relacionadas aos EAC fora de um Serviço fixo. Os Serviços de EAC Itinerantes Tipo II ou Tipo III deverão ser vinculados a um Serviço Tipo III fixo. Esta modalidade não permite a prestação de qualquer tipo de assistência com a sua estrutura física em movimento, devendo realizar medidas e verificações após a montagem do instrumento no local de parada para atendimento, bem como manter os registros dos atendimentos.
- Exame de Análises Clínicas (EAC): conjunto de processos que tem o objetivo de determinar o valor ou as características de uma propriedade, também conhecidos como ensaios ou testes de análises clínicas.
- Material biológico primário: tecido ou fluido constituinte do organismo humano, tais como excrementos, fluidos corporais, células, tecidos, órgãos ou outros fluidos de origem humana ou isolados a partir destes que não sofreram alterações no seu estado natural ou que não foram submetidos a atividades que visam a preparação para a análise, por exemplo: centrifugação, filtração, resfriamento, aquecimento, homogeneização, transferência, entre outros.
Além disso, a norma atualizou definições da RDC Anvisa nº 302/2005, sendo as principais:
- Material biológico ou amostra biológica: tecido ou fluido constituinte do organismo humano, tais como excrementos, fluidos corporais, células, tecidos, órgãos ou outros fluidos de origem humana ou isolados a partir destes.
- Metodologia própria (in house): metodologia analítica, reagentes ou sistemas analíticos desenvolvidos, produzidos e validados pelo Serviço Tipo III para uso em seu ambiente, podendo ser aplicada em pesquisa ou em apoio ao diagnóstico e terapêutico. Notar que somente o Serviço Tipo III pode desenvolver e utilizar metodologia própria, sendo proibida a comercialização, repasse, doação ou entrega para consumo de reagentes ou quaisquer produtos provenientes desta operação. Estabelecimentos que utilizarem metodologia própria devem ter sua adequabilidade demonstrada por meio de fundamentação científica e condições operacionais, por meio de estudo de validação, guias ou padrões nacionais.
Contratualização das atividades
A nova RDC estabelece um capítulo específico sobre a forma de contratualização das atividades relacionadas aos EAC, de forma que os contratos deverão prever requisitos mínimos, como:
- Obrigações, responsabilidades e funções dos envolvidos;
- Requisição de documentos que comprovem sua regularidade sanitária;
- Critérios de controle e de qualificação das etapas da cadeia;
- Fluxo de registros para controle de rastreabilidade;
- Cumprimento de todos os requisitos das fases analítica, pré-analítica e pós-analítica.
Outras inovações
O novo regulamento permite que o Ministério da Saúde e as Secretarias de Saúde estaduais, municipais ou do Distrito Federal definam outros ambientes para execução de EACs no âmbito de políticas públicas de promoção e proteção da saúde, desde que seja assegurado o cumprimento dos requisitos previstos na norma. Neste caso, a realização de EAC em ambiente externo deverá ocorrer sob a responsabilidade técnica de um Serviço que executa EAC e ser notificada ao órgão de Vigilância Sanitária local.
Outra novidade é a obrigação estabelecida para que os serviços implementem uma política de sistemas de informação, estabelecendo uma sistemática de acesso a dados e informações dos pacientes e dos profissionais do serviço, bem como controlando o acesso a lançamento e alterações de dados e resultados dos exames dos pacientes (incluindo históricos com datas, horários, usuário e local em que ocorreu o cadastro ou alteração das informações).
Além disso, os estabelecimentos deverão desenvolver processos sistematizados para liberação de resultados dos exames e laudos dos pacientes, seja ela automática ou manual; política de privacidade e confidencialidade da informação; e sistemática definida e documentada de proteção contra acessos não autorizados.
Alterações na RDC Anvisa nº 44/2009
A RDC aprovada impacta de forma significativa o setor de serviços farmacêuticos ao alterar a RDC Anvisa nº 44/2009, que dispõe sobre as boas práticas para serviços farmacêuticos em farmácias e drogarias. A nova redação estabelece que a prestação de serviço de atenção farmacêutica compreende a atenção farmacêutica domiciliar, a aferição de parâmetros fisiológicos, a execução de EAC e a administração de medicamentos, passando a permitir uma ampla gama de exames em farmácias (Serviço Tipo I).
Diferentemente da versão anterior, a norma não estabelece mais um rol taxativo de quais exames poderão ser realizados em Serviços Tipo I. De acordo com posicionamento público da Abrafarma, a nova regra permitirá a realização dos seguintes exames:
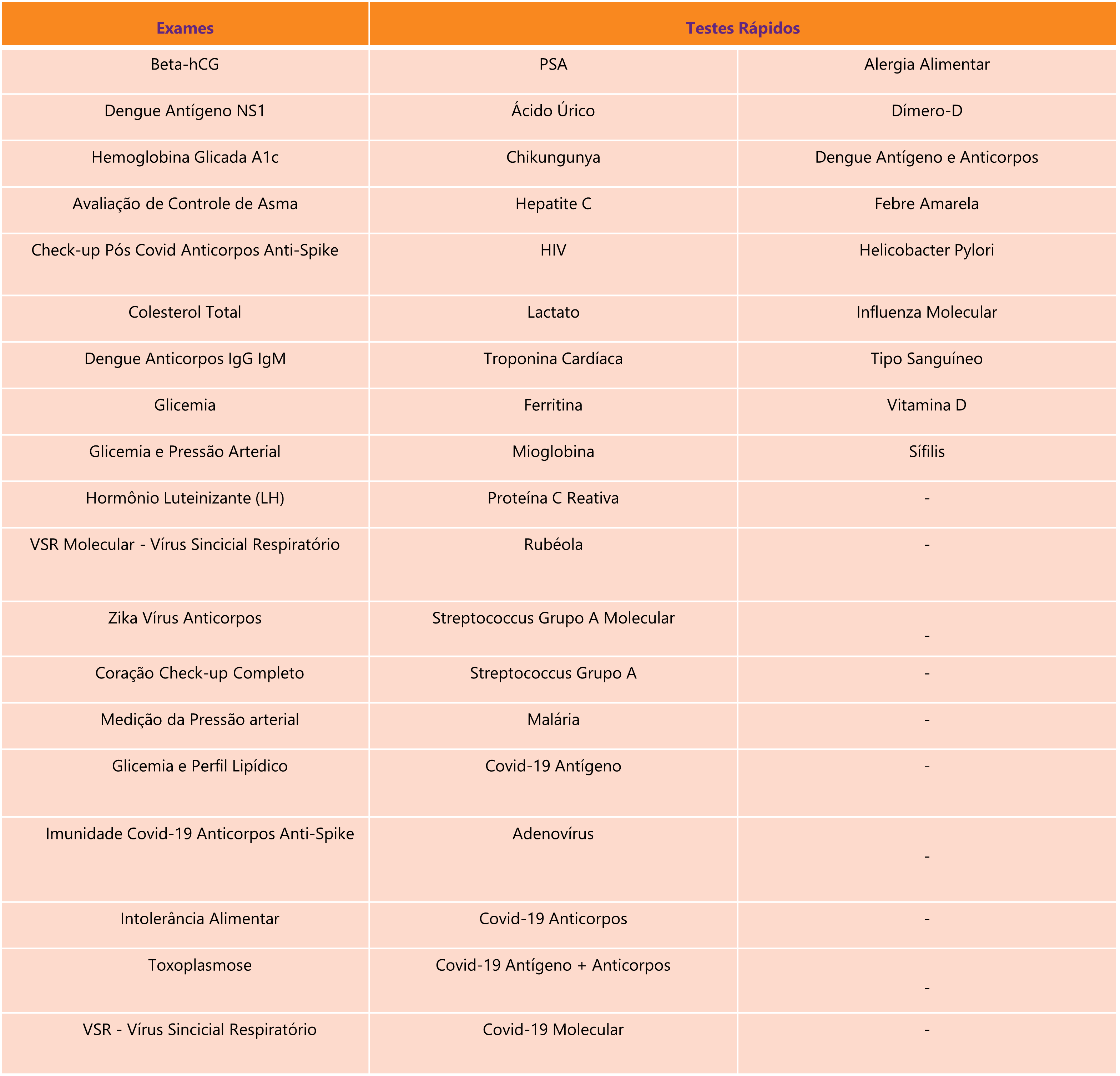
De acordo com a nova regra, a aferição de parâmetros fisiológicos e a execução de EAC nestes estabelecimentos não terão objetivo de diagnóstico.
Adequação dos serviços
Os estabelecimentos que efetuam os serviços tratados na nova norma terão até 10 de novembro de 2023 para se adequarem aos novos requisitos, devendo observar inclusive as regras referentes à infraestrutura física do local que executa EAC quando realizadas reformas ou ampliações de serviços existentes, construções novas ou adequações de estabelecimentos anteriormente não destinados a serviços de saúde ou que tiveram alteração no uso de um ou mais de seus ambientes.
Para mais informações sobre o tema, conheça a prática de Life Sciences e Saúde do Mattos Filho.



