
Autorizações de Uso Emergencial para vacinas da Covid-19: entenda decisão inédita da Anvisa
Com a aplicação de vacinas, Brasil entra em nova fase no combate à pandemia e deverá seguir as regras previstas na MP nº 1.026/2021
Assuntos
Em 17 de janeiro de 2021 a Diretoria Colegiada (Dicol) da Agência Nacional de Vigilância Sanitária (Anvisa) aprovou por unanimidade e de forma inédita a concessão de duas Autorizações de Uso Emergencial (AUE) – para as vacinas CoronaVac, desenvolvida pela farmacêutica Sinovac em parceria com o Instituto Butantan, e Covishield, produzida pela farmacêutica Serum Institute of India em parceria com a AstraZeneca/Universidade de Oxford e Fiocruz.
O procedimento para análise de pedidos de AUE, estabelecido pela Anvisa em dezembro de 2020, considera uma avaliação dos riscos e benefícios de cada produto e é baseada em evidências disponíveis relacionadas a aspectos de eficácia, segurança, biotecnologia, boas práticas de fabricação e farmacovigilância. É importante ressaltar que as AUEs não substituem o registro sanitário, usualmente concedido pela Anvisa.
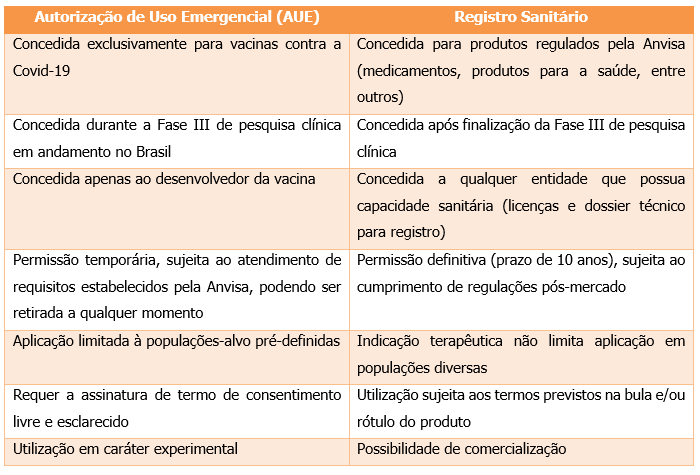
Confira abaixo as principais diferenças entre os dois mecanismos:
Além das evidências científicas apresentadas pelas desenvolvedoras de cada vacina, a decisão da Dicol também considerou a ausência de alternativas terapêuticas disponíveis para tratamento de pacientes diagnosticados com a Covid-19, bem como a continuidade da situação de emergência em saúde pública de importância nacional e internacional.
As empresas requerentes deverão dar continuidade aos estudos e à geração de dados de vida real, inclusive no que se refere ao monitoramento sobre a segurança das vacinas e seus efeitos a longo prazo, de modo a permitir o registro sanitário em caráter definitivo perante a Anvisa.
Nova fase no plano de combate à pandemia
Com a concessão das duas AUEs pela Anvisa, o Brasil entra em uma nova fase no combate à pandemia decorrente da Covid-19, passando a distribuir as doses de vacinas disponíveis de acordo com o Plano Nacional de Operacionalização da Vacinação contra Covid-19, elaborado pelo Ministério da Saúde, bem como os requisitos estabelecidos na Medida Provisória nº 1.026/2021 (MP nº 1.026/2021), publicada em 07 de janeiro de 2021. Confira os principais pontos da MP:
- Determinação para que estabelecimentos de saúde, públicos e privados, registrem diariamente e de forma individualizada os dados referentes a aplicação das vacinas contra a Covid-19 e de eventuais eventos adversos, em sistema de informação disponibilizado pelo Ministério da Saúde.
- O profissional de saúde responsável pela administração da vacina com AUE concedida pela Anvisa deverá informar ao paciente que o produto ainda não possui registro na Anvisa, tendo somente sido concedida a AUE, além dos potenciais riscos e benefícios do produto.
- Determinação para que, mediante solicitação de autoridade sanitária, pessoas jurídicas de direito privado compartilhem dados essenciais à identificação de pessoas infectadas, em tratamento ambulatorial ou hospitalar, ou com suspeita de infecção pela Covid-19, sujeito aos regulamentos vigentes para proteção de dados pessoais.
- Validade de receituários médicos ou odontológicos de medicamentos sujeitos a prescrição e de uso contínuo (exceto medicamentos sujeitos ao controle especial) será estendida até o término do Plano Nacional de Operacionalização da Vacina.
- Estabelecimento de regramento de direito público customizado para a aquisição de vacinas, insumos, bens e serviços de logística, tecnologia da informação e comunicação, comunicação social e publicitária e treinamentos destinados à vacinação contra a Covid-19.
O texto da MP nº 1.026/2021 possui validade de 60 dias, prorrogáveis por igual período. Embora os efeitos jurídicos de uma medida provisória sejam imediatos, seu texto depende de apreciação pelas Casas do Congresso Nacional (Câmara e Senado) para se converter definitivamente em lei ordinária. Se não for apreciada em até 45 dias, contados da sua publicação, a MP entra em regime de urgência, sobrestando todas as demais deliberações legislativas da Casa em que estiver tramitando.
Autorizações de importação e distribuição de vacinas não registradas
De forma similar ao que já está mencionado na Lei Federal nº 13.979/2020, a MP nº 1.026/2021 também estipulou a possibilidade de a Anvisa conceder autorização excepcional e temporária para importação e distribuição de vacinas contra a Covid-19, materiais, medicamentos, produtos para saúde e insumos sem registro na Anvisa e considerados essenciais para o combate à pandemia.
Além das autoridades sanitárias americana, europeia, chinesa e japonesa, a MP nº 1.026/2021 incluiu a entidade regulatória do Reino Unido da Grã-Bretanha e Irlanda do Norte (Medicines and Healthcare Products Regulatory Agency – MHRA) no rol de agências nas quais o produto deve estar registrado.
Embora a MP deixe de mencionar um prazo para análise da Anvisa, tem-se o seguinte cenário:
- para a concessão de autorização para importação e distribuição de produtos registrados perante o FDA, EMA, PMDA e NMPA, a Anvisa estaria sujeita ao prazo de 72 horas, conforme previsto na Lei nº 13.979/2020, cuja vigência permanece por força da decisão proferida pelo Ministro Ricardo Lewandowski do Supremo Tribunal Federal (STF), nos autos da ADI nº 6625 MC/DF;
- para concessão de autorização para importação e distribuição de produtos registrados perante a MHRA, aplicam-se os prazos previstos nas regulações da Anvisa, de acordo com cada tipo de produto.
Plano Nacional de Operacionalização da Vacinação
Conforme previsto na Constituição Federal, é de competência concorrente da União, Estados e Distrito Federal legislar sobre a “proteção e defesa da saúde” (artigo 24, XII), bem como é de competência comum a todos os entes, incluindo Municípios “cuidar da saúde e assistência pública” (artigo 23, II).
Com base nesse panorama constitucional, tem sido frequente a judicialização de questões envolvendo a competência dos entes federativos no âmbito da pandemia. Ainda que se trate de medida recente, já é possível identificar controvérsias judiciais relativas ao artigo 13 da MP nº 1.026/2021.
Por exemplo, nos autos da própria ADI nº 6625 MC/DF, em trâmite perante o STF, o Partido Rede Sustentabilidade requereu o aditamento de sua inicial para que fosse declarado que o Plano Nacional de Operacionalização da Vacinação contra a Covid-19, a ser atualizado e coordenado pelo Ministério da Saúde, não impede que Estados, Distrito Federal e Municípios iniciem a vacinação por intermédio de planos estaduais e municipais próprios de vacinação.
Em que pese o mencionado aditamento ainda não tenha sido julgado, ressalta-se que no âmbito da ADPF nº 770 MC/DF, ajuizada pelo Conselho Federal da Ordem dos Advogados do Brasil, o STF já se posicionou no sentido de que os Estados, o Distrito Federal e os Municípios estão autorizados à dispensar as vacinas das quais disponham às respectivas populações, desde que previamente aprovadas pela Anvisa, caso o Plano Nacional de Operacionalização da Vacinação contra a Covid-19 seja descumprido ou não proveja cobertura imunológica tempestiva e suficiente contra a doença.
Para mais informações sobre as regulamentações aplicáveis às vacinas e à Covid-19, conheça a prática de Life Sciences e Saúde do Mattos Filho.


